建立“度量衡”,人源化单抗是IVD企业参考品的理想原料
IVD企业内部参考品
在体外诊断试剂中,参考品是检测系统质量控制的重要组成部分。其主要包括标准品、校准品和质控品。
在IVD检测试剂开发过程中,建立参考系统是产品立项后的首要工作。参考国家标准、行业标准,结合产品的预期性能,建立产品内部参考系统,用于试剂后续研发、生产的质量控制。所谓“兵马未动,粮草先行”。而内部参考品则是参考系统的重要组成部分。
IVD试剂生产企业使用企业内部参考品,即我们常说的“内参”,用于产品研发和生产阶段的质量控制。甚至有些企业成立参考系统部门,承担包括内部参考品制备在内的产品质量控制工作。
内部参考品可以评价关键原材料的性能,以选择最优的原料;可以评价工艺体系,以优化配方;可以验证产品性能,以判断生产产品是否符合预期。可以说,内部参考品就是企业标准,用于质量控制,如“度量衡”,在产品生命周期尤其是研发、生产过程中,负责优化、纠偏、评判,确保产品性能符合设计预期,保证产品的有效性。
我们可以从法规等更深层次去探究为何内部参考品如此重要。
02
医疗器械产品的核心
医疗器械产品的核心是“安全”、“有效”。
2021年3月18日,国务院颁布《医疗器械监督管理条例(2021)》。在条例中,“安全”“有效”两个词出现的频率均高达40次。条例总则第一条即明确:“为了保证医疗器械的安全、有效,保障人体健康和生命安全,促进医疗器械产业发展,制定本条例。”
中国食药监在《医疗器械生产质量管理规范(2015)》也明确“保障医疗器械安全、有效,规范医疗器械生产质量管理”。
《医疗器械注册质量管理体系核查指南》对第二类、第三类医疗器械注册质量管理体系现场核查提出具体操作指南:在产品开发过程中,设计和开发输入应当包含参考物质等;在采购过程中,应当对体外诊断试剂质控品、企业参考品的原材料采购如涉及人体来源的样本,应当重点关注其生物安全性。
多个文件均把“安全有效”置于首要位置,见图1。目的是通过确保医疗器械的安全有效来保障人民健康和生命安全。对IVD产品研发、生产而言,建立精确的参考系统,利用内部参考品,是保证产品安全有效的手段之一。而内部参考品的原料来源、生物安全性等,是“安全有效”不可忽视的问题。

图1:法规文件
03
抗体类内部参考品的原料来源
03
在免疫诊断中,常见的内部参考品包括抗体类和抗原类。抗体类内部参考品的原料来源主要有两个途径:阳性血清和人源化单抗。
阳性血清来源的内部参考品,是通过混合不同个体的血清样本,用阴性血清稀释,再添加其他辅助成分制得。其材料直接来源于人体血液。人源化单抗来源的内部参考品,是用无机盐溶液稀释人源化单抗,添加动物血清或惰性蛋白制得。也可以用阴性血清稀释。其材料来源和成品可不含人体血液成分。
我们尝试从“安全有效”的角度去分析。
(1)生物安全角度。当前,中国对人体血液管理是严禁进出口和自由交易。国务院在《中华人民共和国献血法》、《血液制品管理条例(2016)》等文件中明确:血液原料中可能含有病原体(如HIV、HBV、HCV等),应确保其安全性。《中华人民共和国传染病防治法(1989)》强调:疾病预防控制机构、医疗机构使用血液和血液制品,必须遵守国家有关规定,防止因输入血液、使用血液制品引起经血液传播疾病的发生。禁止非法采集血液或者组织他人出卖血液。因此,相比血液,人源化单抗制备的内部参考品的生物安全性更高。
(2)有效角度。在血清学诊断中常见的标志物是IgG和IgM。人体免疫球蛋白的血清总含量见图2。针对特定抗原决定簇的特异性抗体含量则更少,尤其是IgM。高滴度血液IgG、IgM较难获得,直接影响高值参考品的制备。人源化单抗即可结合特异性标靶,也含有人源序列,可被抗人二抗特异性识别。根据赋值要求,添加人源化单抗以制备任意值的参考品。

图2:人体免疫球蛋白的血清总含量数据来源:《人源化抗体研究历程及发展趋势》林芸
(3)应用角度。我们知道血液成分复杂,个体差异更导致不同来源血液的基质有差异。通过混合血液方法制备参考品,控制批内差、批间差的技术难度更大。此外,血液样本中可能存在的药物、激素、溶血现象等,可能会影响检测。人源化单抗保留单抗均一的特性,基质可根据工艺调配,可操作性更广。因此,从生物安全、产品有效性和产品使用三个角度比较,人源化单抗是抗体类内部参考品更理想的原料来源。
当然,血清样本也有其不可替代性。如产品注册的临床试验阶段有严格的样本入组原则。样本应包括不同病例,早、中、晚期,不同性别、不同年龄层次等,以便能反映该病的全部特征。
04
人源化单抗参考品的使用
实际上,使用人源化单抗制备参考品应用于诊断试剂早有先例。中国药监局发布的包括《肺炎支原体IgM/IgG抗体检测试剂注册技术审查指导原则》等文件中,提及人源化抗体可作为参考品使用。见图3。

图3:《肺炎支原体IgM/IgG抗体检测试剂注册技术审查指导原则》
在Abbott一项关于弓形虫参考品的研究中,发现人源化单抗制备的参考品与病态血清相比,两者相关性高达0.98以上,且人源化单抗具有更高特异性。见图4。
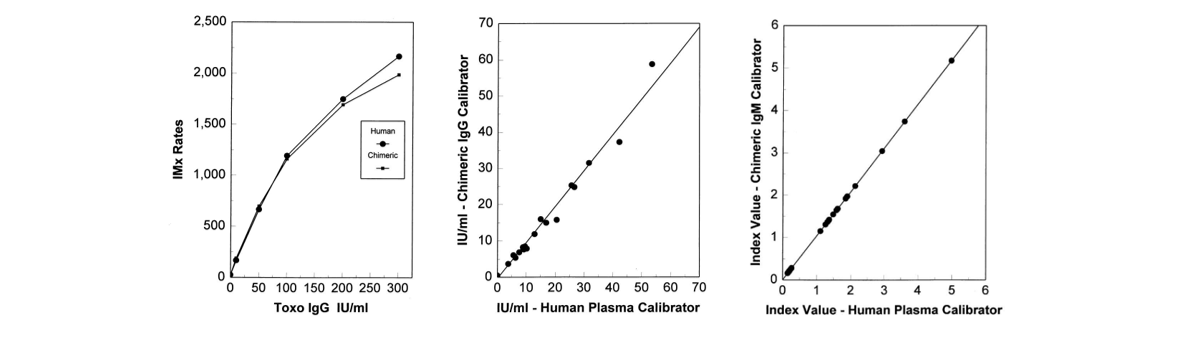
图4:弓形虫的人源化单抗参考品与病态血清比较)图片来源:《RecombinantMouse-Human Chimeric Antibodies as Calibrators in Immunoassays That MeasureAntibodies to Toxoplasma gondii》
05
总结
医疗器械是国家“十四五”规划的重要组成部分,通过确保医疗器械的安全有效来保障人民健康和生命安全。同时,安全有效也是医疗器械技术审评的核心。对于IVD生产厂家而言,建立安全有效的内部参考系统,是实现产品安全有效的内部保障。人源化单抗在有效方面可满足参考品的技术要求,在安全方面可满足国家对生物安全要求,是制备参考品的理想原料。参考资料
1、《医疗器械监督管理条例(2021)》
2、《医疗器械生产质量管理规范(2015)》
3、《医疗器械注册质量管理体系核查指南》
4、《中华人民共和国传染病防治法(1989)》
5、定性检测用体外诊断试剂的企业内部参考品的设置,董劲春。
6、体外生物诊断试剂参考物质的现状与发展,王菲菲。
7、Consensusof a Group of Professional Societies and Diagnostic Companies.
