临床免疫检验中的15大干扰因素,不知道怎么能行?
干扰物是临床实验室检测误差的一个很重要的来源,它们在某种程度上对病人来说表现为是一种危害。常规工作中精密度通过室内质控监控,准确性通过与参考物质作比较试验进行验证,但实验室不能很容易的检测干扰物质引起地误差。
广义上干扰物是导致分析物浓度或催化活力出现偏移的物质,如免疫法干扰常由交叉反应所致,因此,干扰物通过干扰作用来影响分析特异性,从干扰物来源,干扰作用分为内源性和外源性干扰。//一、内源性干扰物质//
1、类风湿因子(Rheumatoidfactors,RF)
类风湿因子(rheumatoid factor,RF)是一种抗人或动物IgG分子Fc片段抗原决定簇的抗体,是以变性IgG为靶抗原的自身抗体。RF最初由Rose等(1984年)在类风湿性关节炎(RA)患者血清中发现。RA患者体内有产生RF的B细胞克隆,在变性IgG或EB病毒的直接作用下可大量合成RF。RF主要为IgM类自身抗体,但也有IgG类、IgA类、IgD类和IgE类。

人血清中IgM、IgG型类风湿因子(RF)可以与ELISA系统中的捕获抗体及酶标记二抗的Fc段直接结合,从而导致假阳性。
类风湿因子干扰的排除
(1)用F(ab)替代完整的IgG。
(2)标本用联有热变性(63°C,10min)IgG的固相吸附剂处理(将热变性IgG加入到标本稀释液中同样有效)。
(3)检测抗原时,可以用2-巯基乙醇等加入到标本稀释液中,使RF降解。
//////////
2、嗜异性抗体
嗜异性抗体(Id)是由低纯度抗原引起的,又称之为对非特异性抗原产生的抗体应答。
天然的嗜异性抗体(IgG)可分为两类:
- 一类(85%的假阳性或假增高由其引起)可结合于山羊、小鼠、大鼠、马和牛IgG的Fab区域,但不与兔IgG的Fab区结合。
- 另一类(15%的假阳性或假增高由其引起)可结合于小鼠、马、牛和兔IgG的FC区表位,但不与山羊和大鼠IgG的FC区表位结合。嗜异性抗体可通过交联固相和酶标的单抗或多抗而出现假阳性或假增高反应。
- 其也可造成假阴性或假降低的结果。
嗜异性抗体干扰的排除
使用特异的兔F(ab’)2片段作为固相或酶标抗体。
在标本或标本稀释液中加入过量的动物Ig,封闭可能存在的嗜异性抗体。但加入量不足或亚类不同时无效。
使用靶特异的非Ig亲和蛋白(Affibody)替代固相或酶标抗体之一。采用噬菌体展示技术展示来自单个金黄色葡萄球菌A蛋白(SPA)联合文库的人IgA结合亲和蛋白,用于IgA的测定,不受异嗜性抗体的影响。
使用特异的鸡抗体作为固相和测定抗体。
//////////
3、人抗动物(如小鼠、免、羊等)抗体
人抗小鼠抗体(human anti-mouse antibodies,HAMA):抗鼠抗体对使用鼠源性单克隆抗体的免疫测定,可产生假阳性(定量检测假增高)或假阴性(定量假降低)结果。
干扰排除的方法
使用特异的抗体F(ab’)2片段作为固相或测定酶标抗体。
在标本或标本稀释液中加入过量的鼠Ig,封闭可能存在的抗鼠抗体。
使用特异的鸡抗体IgG作为固相和测定抗体。鸡IgG不与人抗鼠抗体反应。因而,用其作为固相或酶标抗体不会出现假增高或假降低结果。
//////////
4、自身抗体
自身抗体如抗甲状腺球蛋白、抗胰岛素、抗甲状腺激素抗体等,能与其相应靶抗原结合形成复合物,在免疫测定方法中可干扰相应抗原抗体的测定。
自身抗体干扰排除的方法
测定前需用理化方法将其解离后再测定。
//////////
5、补体
补体(complement,C)是存在于正常人和动物血清与组织液中的一组经活化后具有酶活性的蛋白质。早在19世纪末Bordet即证实,新鲜血液中含有一种不耐热的成分,可辅助和补充特异性抗体,介导免疫溶菌、溶血作用,故称为补体。补体是由30余种可溶性蛋白、膜结合性蛋白和补体受体组成的多分子系统,故称为补体系统(complement system)。根据补体系统各成分的生物学功能,可将其分为补体固有成分、补体调控成分和补体受体(CR)。
ELISA系统中固相一抗和标记二抗过程中,抗体分子发生变构,其Fc段的C1q分子结合位点被暴露出来,使C1q可以将二者连接起来,从而造成假阳性。
补体干扰的排除
1、用EDTA稀释标本。
2、用53°C,10min加热血清使C1q灭活。
//////////
6、溶菌酶
溶菌酶(lysozyme)又称胞壁质酶(muramidase)或N-乙酰胞壁质聚糖水解酶(N-acetylmuramide glycanohydrlase),是一种能水解致病菌中黏多糖的碱性酶。主要通过破坏细胞壁中的N-乙酰胞壁酸和N-乙酰氨基葡糖之间的β-1,4糖苷键,使细胞壁不溶性黏多糖分解成可溶性糖肽,导致细胞壁破裂内容物逸出而使细菌溶解。溶菌酶还可与带负电荷的病毒蛋白直接结合,与DNA、RNA、脱辅基蛋白形成复盐,使病毒失活。因此,该酶具有抗菌、消炎、抗病毒等作用。
溶菌酶可与等电点较低的蛋白有强的结合能力。免疫球蛋白等电点约为5,因此,在双抗体夹心法测定中,溶菌酶可在包被的IgG和酶标的IgG间形成桥接,从而导致假阳性或假增高结果。
排除方法
为保证免疫测定的可靠性,有必要从标本中去除溶菌酶或将其封闭,Cu2+离子和卵白蛋白可有效地封闭溶菌酶,防止其联接IgG。
//////////
7、抗试剂成份的抗体
抗链霉亲合素抗体(anti-streptavidin antibodies)[6-8]:链霉亲合素(streptavidin)是由Streptomyces avidinni产生的,机体为什么会出现抗链霉亲合素抗体的原因目前尚不清楚。
抗钌抗体(antiruthenium antibodies)。[9,10]
//////////
8、被动获得的外源抗体或抗原
静脉输注免疫球蛋白获得抗病原体的抗体(如抗梅毒抗体、抗-HCV、抗-HBs等)[11-13];新生儿获得的来自母体的特异IgG;新生儿获得的来自乙肝“大三阳”母亲的HBeAg。[13]
//////////
9、交叉反应(cross reaction)
交叉反应是两种来源不同的抗原,彼此之间可以有相同的抗原决定簇,由此决定簇刺激机体产生的抗体不仅可分别与其自身表面的相应抗原表位结合,而且还能与另一种抗原的相同表位结合发生反应,称为交叉反应。
交叉反应现象的形成可能与下列因素有关:
1、共同抗原,不同生物体的某些生物大分子具有相同的抗原结构;
2、共同表位,不同的生物大分子的某些片段(肽段)具有相同的表位;
3、相似表位,不同的生物大分子,其表位的部分空间构象十分类似,可以和同一种抗体的互补决定区相契合。
激素、小分子半抗原等易受到交叉反应影响。
//////////
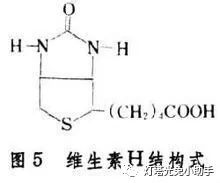
10、生物素(biotin)
生物素又被称为维生素B7或维生素H,是一种水溶性B族维生素。生物素的缺乏主要会损害皮肤、粘膜和神经系统,在普通人群中长期的生物素缺乏可能导致毛发、指甲、皮肤的损害。
生物素-亲合素系统是上世纪70年代末发展起来的一种新型生物反应放大系统。现被广泛应用于医学各领域。在体外诊断的实际应用中更是具有巨大的优越性,生物素可与几乎所有生物大分子结合,亲和力高,结合稳定,灵敏度高,具有多级放大作用。
生物素干扰存在于使用生物素-亲和素系统或生物素-抗生物素系统的检测中。与仪器厂家、仪器型号、发光底物无关,同一厂家不同项目包被方式也可能不同。生物素对化学发光产生干扰需要一定的浓度,不同项目/试剂抗生物素干扰的能力不同。生物素干扰可能产生假阳性,也可能产生假阴性。一般来说,夹心法产生假阴性,竞争法产生假阳性。
使用了生物素-链霉亲合素(streptavidin-biotin)系统的检测系统
Access,DxI and DxC (Beckman Coulter);
Elecsys,Cobas and Modular platforms (Roche Diagnostics);
Isys platforms (Immuno Diagnostic System);
Ortho Vitros platform (Ortho Clinical Diagnostics);
Dimension Vista,Exl,Immulite platforms (Siemens Healthineers)//二、外源性干扰物质//
1、溶血
溶血(Hemolysis)红细胞破裂,血红蛋白逸出称红细胞溶解,简称溶血。可由多种理化因素和毒素引起。在体外,如低渗溶液、机械性强力振荡、突然低温冷冻(-20℃~-25℃)或突然化冻、过酸或过碱,以及酒精、乙醚、皂碱、胆碱盐等均可引起溶血。
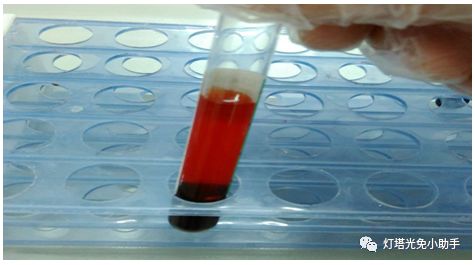
标本溶血时可释放出大量具有过氧化物酶活性的血红蛋白,在以辣根过氧化物酶为标记的ELISA测定中,会导致非特异性显色,干扰测定结果。
解决方法
标本采集和处理时必须注意避免溶血。
//////////
2、标本被细菌污染
细菌菌体中可能含有内源性辣根过氧化物酶,在ELISA试验中可产生非特异性显色而干扰测定结果。
//////////
3、标本保存时间过长
部分项目因稳定性时间较短,需严格注意标本保存时间。
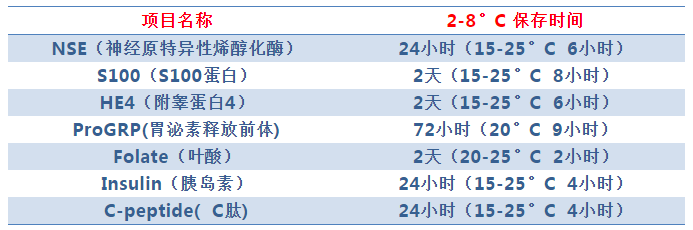
//////////
4、标本凝固不全
血液采集后,如收集管中无促凝剂和抗凝剂,则血液通常在半小时后开始凝固,18~24h完全凝固。日常检验中,常在血液还未开始凝固时即离心分离血清,此时因血液没有完全凝固,离出的“血清”并非为完全的血清,其中仍残留部分纤维蛋白原,易形成干扰,造成假阳性。
解决方法
血液标本采集后,应使其充分凝固后再分离血清,或标本采集时用带分离胶的采血管或于采血管中加入适当的促凝剂。
//////////
5、样本离心时间
个别标本由于离心制备不彻底,造成假阳性结果,如果忽略掉就会给临床造成误诊,引起不必要的医疗纠纷。故建议检验人员若遇到疑似阳性标本,最好延长离心时间,重复测定,可以降低假阳性率,增加检验结果的准确性。
结 论
干扰物质影响分析特异性,检验工作者在日常工作中需格外注意,必须减少样本中的干扰物质,避免对测定结果产生影响。
【参考文献】
↑↓滑动查看
1.李金明-影响临床常规免疫检测结果的干扰物质
2.Georges A, Charrie A, Raynaud S, Lombard C, Corcuff JB. Thyroxin overdose due to rheumatoid factor interferences in thyroid-stimulating hormone assays. Clin Chem Lab Med. 2011;49:873—5
3.Chin KP, Pin YC. Heterophile antibody interference with thyroid assay. Intern Med. 2008;47(23):2033–7.
4.Mongolu S, Armston AE, Mozley E, Nasruddin A. Heterophilic antibody interference affecting multiple hormone assays: is it due to rheumatoid factor? Scand J Clin Lab Invest 2016;76:240–2
5.Kricka LJ. Human ant-animal antbody interference in immunological assays. Clin Chem 1999;45:942–56
6.Rulander NJ, Cardamone D, Senior M, Snyder PJ, Master SR. Interference from anti-streptavidin antibody. Arch Pathol Lab Med 2013;137:1141–6
7.Peltier L, Massart C, Moineau MP, Delhostal A, Roudaut N. Antistreptavidin interferences in Roche Thyroid immunoassays: a case report [letter]. Clin Chem Lab Med 2016;54:e11–4
8.Khieng V, Stevens C. Vitamin D toxicity? a case study. NZ J Med Lab Sci 2010;64:44–50
9.Buijs MM, Gorgels JP, Endert E. Interference by antiruthenium antibodies in the Roche thyroid-stimulating hormone assay. Ann Clin Biochem. 2011;48(Pt 3):276–81
10. Ohba K, Noh JY, Unno T, Satoh T, Iwahara K, Matsushita A, et al. Falsely elevated thyroid hormone levels caused by antiruthenium interference in the Elecsys assay resembling the syndrome of inappropriate secretion of thyrotropin. Endocr J 2012;59:663–7
11.Constable SA, Parry CM, Enevoldson TP, Bradley M. Positive serological tests for syphilis and administration of intravenous immunoglobulin. Sex Transm Infect. 2007;83(1):57-8
12.Rossi KQ, Nickel JR, Wissel ME, O’Shaughnessy RW. Passively acquired treponemal antibody from intravenous immunoglobulin therapy in a pregnant patient. Arch Pathol Lab Med. 2002;126(10):1237-8.
13. Wang JS, Chen H, Zhu QR. Transformation of hepatitis B serologic markers in babies born to hepatitis B surface antigen positive mothers. World J Gastroenterol. 2005;11(23):3582-5.
14.Sturgeon C M and Viljoen A. Ann Clin Biochem 2011; 48: 418–432.
15.亚心检验医学团队-化学发光中的生物素干扰
16.Clerico A and Plebani M, Clin Chem Lab Med 2017; 55(6): 777–779
来源:灯塔光免小助手
编辑:柒柒 审校:十一
