固相载体,免疫分析技术界的航空母舰

现代免疫分析技术源于标记技术在免疫学中的应用。科技的进步推动免疫分析技术的迅速发展,从20世纪40年代开始,免疫分析技术发展的里程碑依次包括放射免疫试验(radio immnuoassay,RIA)、酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)、侧向免疫层析(lateral flow immunoassay,LFIA)、化学发光免疫分析(chemiluminescence immunoassay,CLIA)等。其中,每种免疫分析技术又分化出多种形式,多元免疫分析方法优势互补。
伴随着免疫分析技术的发展,免疫反应载体也相应有不同种类。作为基础性功能材料,载体是抗原抗体特异性结合的支撑物,提供免疫反应的场所,决定了免疫分析技术的性能下限。

在目前常见的免疫分析技术中,ELISA、LFIA和CLIA的部分关键信息如表1。
CLIA技术的灵敏度可以达到皮克级,相比其他两种分析技术高,联系其配体用量,灵敏度更好似乎在情理之中。但是配体用量是唯一的影响因素吗?为什么不把ELISA和LFIA的配体用量提高,以达到更高的灵敏度呢?
此外,在免疫分析中有一个有趣的现象。在某一技术平台性能表现优越抗体,但是在另一个技术平台却可能达不到预期。原因是什么?答案就在固相载体上。

下面我们来了解在三种免疫分析技术中,固相载体与配体的相互作用。
A、酶联免疫吸附试验
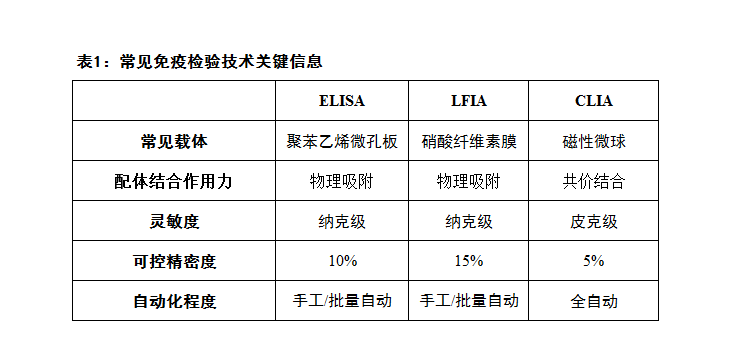
ELISA传统的固相载体是聚合物,常见是聚苯乙烯,其他包括聚丙烯,聚乙烯和环烯烃共聚物的共混物。配体(如抗体)通过疏水作用力、静电作用力与载体表面结合(被动吸附)。微孔板常规的造型及尺寸如图1,载体提供的结合面积约是2.5 cm^2。
当配体附着于固相表面时,其构象会根据表面的化学性质而改变。在许多情况下,配体会展开以暴露疏水性区域,这些区域与载体表面相互作用。为了避免疏水作用导致配体构象改变,产生了改性载体,包括:
1)在载体表面引入亲水性物质;
2)引入双官能交联剂实现共价偶联等。
但总体而言,被动吸附依然是当前ELISA的主流。
B、侧向层析侧
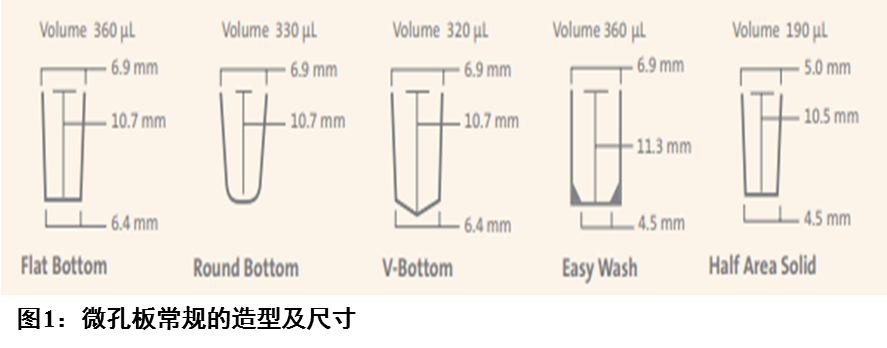
向层析技术在POCT中应用最为广泛,其以大孔径的微孔滤膜为载体(主要代表是硝酸纤维素膜)。层析条的典型结构如图2。膜上配体的首要功能是捕获样品中待测物,实验结果依赖于配体对待测物的良好结合,因此持续高水平的蛋白结合很重要。
在大多数情况下,硝酸纤维素膜的蛋白质结合能力取决于可固定化的聚合物表面积。我们知道,膜的表面积由孔径、孔隙率、厚度以及在较小程度上由聚合物独有的结构特征决定。通常膜的IgG最大结合量可达50-200 μg/cm^2。
与聚苯乙烯载体不同的是,硝酸纤维素膜通过硝酸酯的强偶极与蛋白质内肽键的强偶极相互作用而静电结合配体,如图3。

C、化学发光
磁性微球作为CLIA中生物反应的固相载体出现,负载上各类生物活性分子后均匀分散于均相中,完成反应并迅速分离。基于载体的特性,CLIA具有灵敏度高、自动化等一系列优点,近年来已在生物分析的各个领域占据了重要地位并不断有新开发的方法和设备见诸报道。
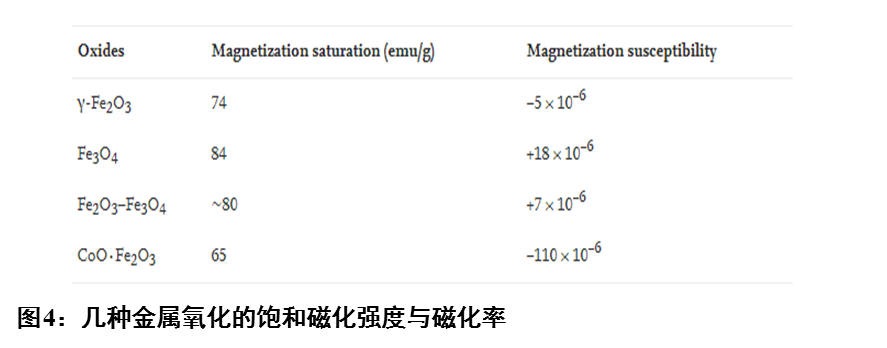
超顺磁性和表面功能化是磁性微球的关键要素。图4展示了几种金属氧化的饱和磁化强度与磁化率,氧化铁是常用的磁性材料。此外,磁滞回线表明纳米磁性材料具有超顺磁性。在表面官能团方面,最常见的是羧基、氨基、甲苯磺酰基和亲和素。蛋白质分子含有端羧基和氨基,因此能确保蛋白质定向与磁性微球偶联。
化学发光磁性微球的常见粒径是1.0-3.0 μm。微球虽小,却可以提供较大的比表面积。相比ELISA与LFIA的固相载体,磁性微球可以提供更多的配体结合位点。球体的比表面积公式是A/M(m^2/g)=6/ρD(其中:ρ表示密度,D表示直径)。假设磁性微球是规则球体,密度为1.2 g/cm^3,粒径为3.0 μm,计算得比表面积为1.67 m^2/g。按照常规做法,每次检测可以提供约数平方厘米的配体结合面积。
此外,抗原抗体的结合依赖两者随机碰撞,推动反应向动态平衡发展。磁性微球均匀分布在液相中,可以增加配体与待测物的碰撞概率和次数,最终反映在检测的高灵敏度上。
D、 三种技术的对比
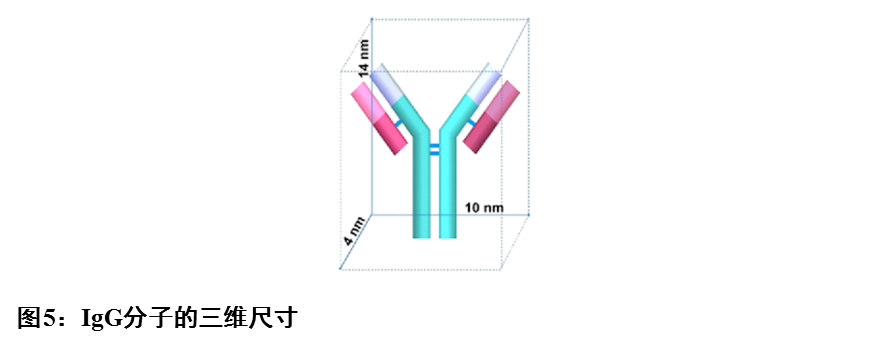
配体与待测物的反应时间,ELISA通常是30min,侧向层析则低于1秒。侧向层析通过提高配体用量来弥补反应时间短的不足,因此分析灵敏度仍可达到纳克级。但是受限于蛋白质结构与斯科托半径,载体可结合的配体有限,况且配体浓度过高会对特异性产生负面影响。因此,通过提高配体数量来提升灵敏度,作用有限。图5表示IgG分子的三维尺寸。
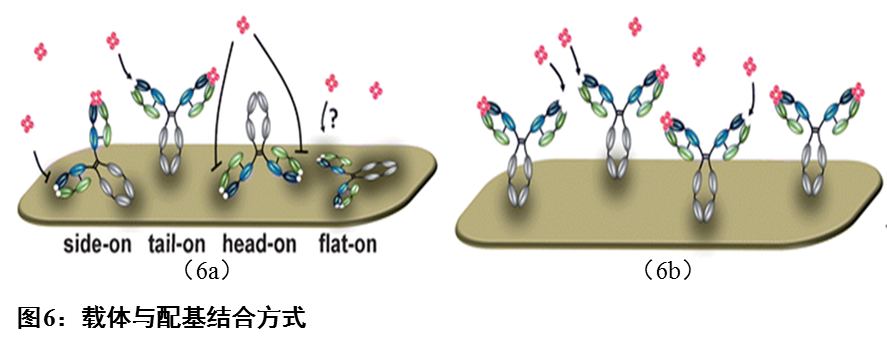
以IgG为例,对比配体与载体的结合方式,通过疏水作用力与静电作用力,配体可以吸附在固相载体上。尽管此方法提供了最简单的附着途径,但是不可控。抗体以随机的方式固定,可能导致变性或在随后的反应中被置换。如图6a,若抗体的Fab端与固相载体结合,则会产生空间位阻,阻碍其在后续步骤中与抗原结合。如图6b,特定基团的共价结合,可以提供定向偶联,使载体-配体复合物结构均一,降低空间位阻影响。
此外,如前文提到,磁性微球可以提供更大的配体结合面积,均匀分布在液相中能提高检测的灵敏度。因此,CLIA相比传统的ELISA和LFIA,可以达到更高的灵敏度。 配体固定化的目标是以一种正确的空间取向将配体固定到载体表面,在完全保留配体构象和活性的同时最大化待测物的结合能力,这对分析性能至关重要。而磁性微球提供较大的比表面积和共价偶联方式,是实现该目标的理想载体。
这在临床诊断中是有意义的,比如高敏肌钙蛋白的临床诊断。《高敏感方法检测心肌肌钙蛋白临床应用中国专家共识(2014)》指出:高敏感心肌肌钙蛋白是指用敏感方法测定cTn,并对正常人群的第99百分位值处的变异系数、健康人群低于第99百分位值的检出率等提出更高要求。此外,ESC在《心肌梗死全球通用定义(第四版)》要求cTn分析试剂的CV≤10%。CLIA依托磁性微球的特殊功能,可以突破传统方法的灵敏度及精密度桎梏。
当然,性能不是评判免疫分析技术价值的唯一指标。当前终端需求多样化,免疫诊断相应呈多元化发展。本文尝试从技术角度出发,阐述载体种类对检验性能影响的内在逻辑。

行文至此,载体如何影响免疫分析已有了答案:
(1)空间位阻。每种载体提供固定的结合面积,已然限定配基数量上限。配基浓度过高,或配基结合位点不合适,都会阻碍其后续与待测物结合。
(2)结合方式。相比物理吸附,共价结合是定向偶联,可以提供均一的结合物,精密度表现更理想
(3)反应动力学。抗原抗体反应速率依赖碰撞概率及次数。均匀分布的配体可以加快反应达到动态平衡,利于提高灵敏度。

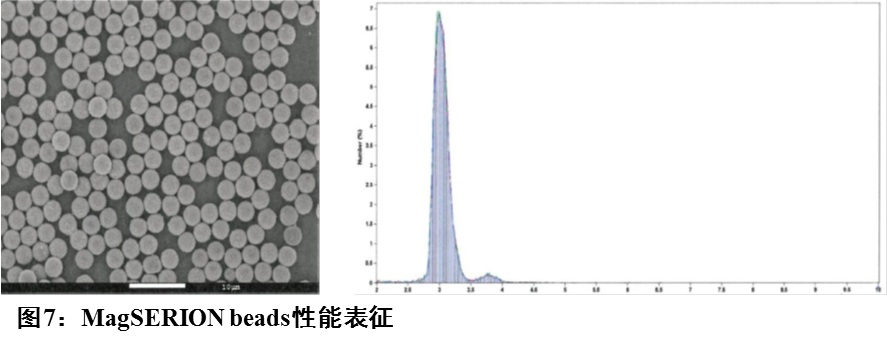
在过去几十年中,免疫分析技术取得了令人瞩目的进展。它将免疫反应的高特异性与检测技术的灵敏度和便利性结合起来,推动免疫分析技术向更灵敏、选择性、低成本的方向发展。载体种类及配体的固定化方式是此发展过程的参与者。作为基础性功能材料,每种载体都有其独特性,支持免疫分析技术实现预期功能。 德国维润赛润推出MagSERION beads系列磁性微球,包括氨基磁珠和羧基磁珠。磁珠平均粒径3.0 μm,表面经亲水处理,单分散性好,磁响应速度快,适用于化学发光免疫分析,工业化量产,稳定批量供应。图7,MagSERION beads性能表征。
产品咨询:
Virion\Serion原料事业部
(+86)18818686988 / 0755-89381139
产品链接:赛润磁珠,为磁微粒技术赋能
部分参考资料: 【1】Orientation and characterization of immobilized antibodies for improved immunoassays (Review).
【2】Magnetic polymer beads: Recent trends and developments in synthetic design and applications.
【3】Technological Development of Antibody Immobilizationfor Optical Immunoassays: Progress and Prospects.
【4】Recent Advances in Analytical Applications of Nanomaterials in Liquid-Phase Chemiluminescence.
【5】Membrane-based lateral flow immunochromatographic strip with Nanoparticles as Reporters for detection A review.
编辑:Steven | 校对:Harris | 责编:Hillson
