原料为王,Serion新冠试剂获评欧洲最佳

截止2020年11月01日,WHO数据显示,目前全球新冠感染人数已超过4567万人,死亡人数已超过118万人,感染的国家和地区已超过235个;近期,美国、法国、英国、俄罗斯、西班牙、意大利、比利时、波兰、捷克、荷兰、德国、乌克兰、伊朗、罗马尼亚等多国的新冠疫情出现二次升高。
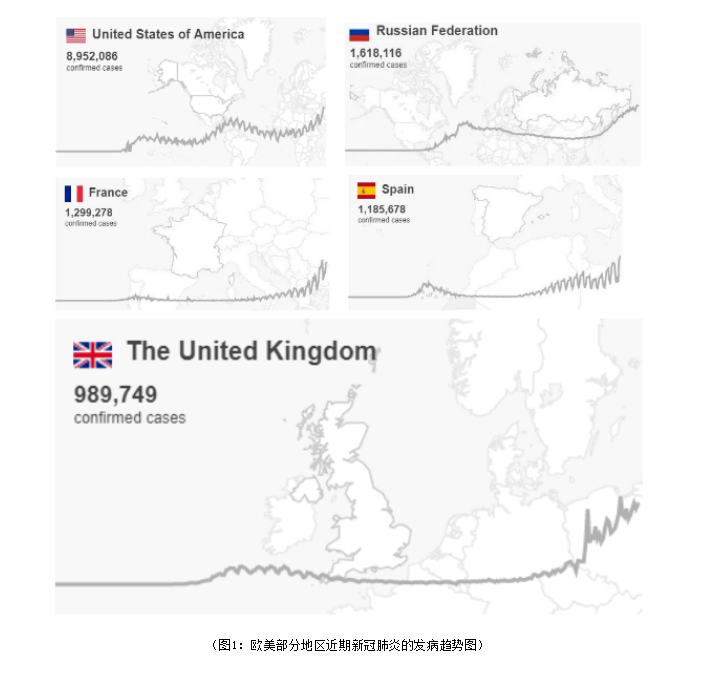
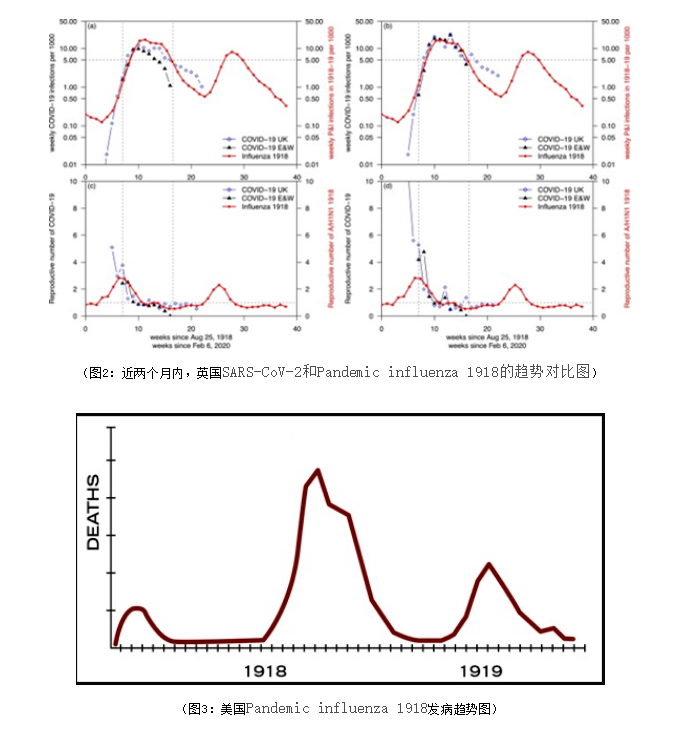
近期,一篇关于英国SARS-CoV-2和Pandemic influenza 1918的对比研究报告显示,在过去的两个月时间里,SARS-CoV-2和Pandemic influenza 1918的趋势惊人的相似。在1918年的流感出现了三次浪潮,分别在夏季、秋季和冬季,关于Pandemic influenza 1918,在美国地区也同样出现了三次浪潮,1918年的世界大流感给世界带来沉重的影响;而今,欧美中东等地区的新冠疫情已出现二次浪潮,是否出现类似1918年的流感疫情那样出现三次浪潮,需要时间去进一步去验证;而无论何时何地面对新发突发传染病,任何时候都需做好科学防控措施,不能掉以轻心。
而今疫情依然肆虐,尤其在疫苗还未上市的情况下,近期欧洲各国传来封城的消息,疫情的警钟再次敲响。虽然经历过初次疫情的突发,面对二次疫情我们更应该谨慎。各地疫情的高发带来对新冠检测的需求,但随着疫情的变化,新冠病毒的检测难度在不断增加。面对无症状患者或者病毒携带者,甚至是二次感染者的存在,单纯的核酸检测已然不足,临床诊断和疫情防控急需核酸+血清学联合检测,更准确的查出携带者的真实情况。
就在2020年10月30日,中华人民共和国驻美利坚合众国大使馆发布《关于搭乘航班赴华人员须进行新冠病毒核酸检测及血清抗体检测双阴性的通知》,要求入境前,核酸及血清学检测均为阴性。不仅如此,中国驻美国、法国、英国、爱尔兰、意大利、波兰等多个国家的大使馆网站陆续发布了《关于搭乘航班赴华人员须凭新冠病毒核酸检测和血清抗体检测双阴性证明登机的通知》。
除了要求持双阴性证明登机外,使馆通知还提醒从使馆所在国出发、经第三国中转乘机赴华人员,须在中转国进行第二次核酸检测和血清IgM抗体检测,并设有检测时间限制。上述通知明确体现了血清学检测的重要性。核酸+血清学检测已然是势在必行,而在众多的试剂中,质量始终是第一位。

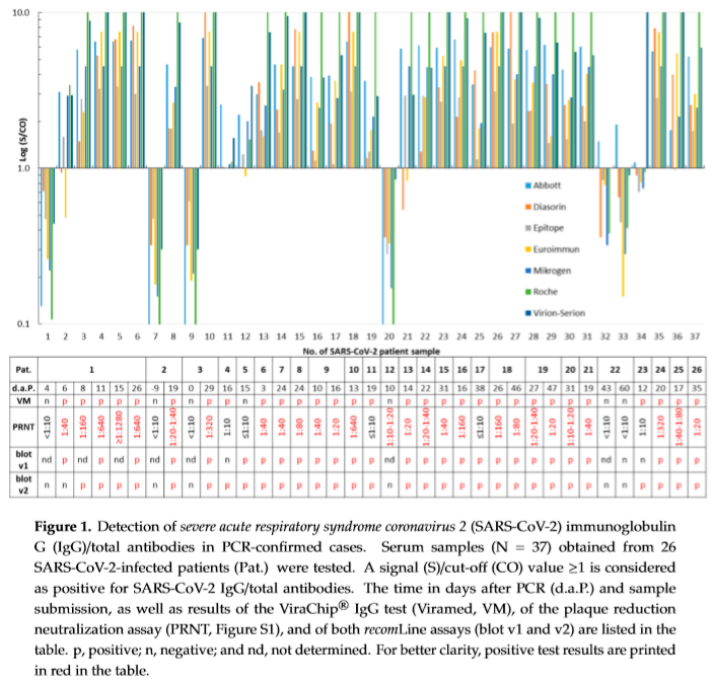
血清学检测的国际最新研究显示,在欧洲最大的医疗中心之一的石勒苏益格–荷尔斯泰因州大学医学中心和德国基尔大学最近发表的《Kinetics of Nucleo- and SpikeProtein-SpecificImmunoglobulin G and of Virus-Neutralizing Antibodies afterSARS-CoV-2Infection》研究报告中,比较了8种检测试剂的性能;经验证,Virion-Serion抗体检测试剂质量效果最佳并推荐用于SARS-CoV-2抗体检测。
(PS:UKSH是欧洲最大的医疗中心之一,在新冠肺炎期间,第一次在全球范围内对新冠肺炎严重程度有关的危险基因进行大规模的基因组研究,并发现变异基因。)

在本研究中,包括26例PCR阳性样品,27例含有抗SARS-CoV-2中和抗体的样本和100例在大流行之前收集的样本。分别测试Abbott、DiaSorin、Epitope、Euroimmun、Mikrogen、Roche、Viramed、 Virion-Serion检测试剂的敏感性、特异性和准确率。
结果显示:Virion-Serion检测试剂的敏感性+特异性最佳; Virion-Serion的准确率优于其他7种检测试剂,性能最佳。(见Table 1.)
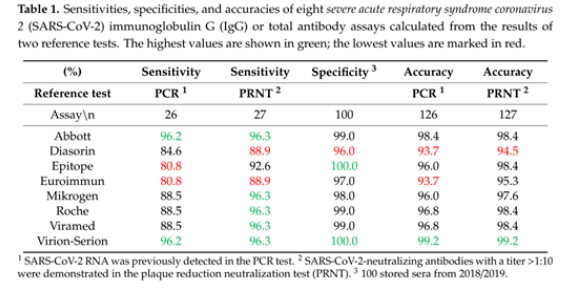
本研究还发现,在轻症感染者中只有Virion-Serion和Abbott的试剂可检测出阳性。
在2018-2019收集的样本中,其中Mikrogen、Roche和Viramed的结果均出现阳性,WB结果显示,与其他HCoVs 229E、HKU-1、NL63、OC43存在交叉反应;而Virion-Serion与新冠其他种属均未出现交叉反应。
以上国际最新研究成果证明了Virion-Serion抗体检测试剂的卓越性能,这一切均源于Virion-Serion自产的高品质的新冠抗原。

Virion\Serion在传染病诊断领域已超过40年,不仅拥有P3生物安全实验室,还具有超过40年研发积累的成功经验和生产高质量原材料的先进技术。
在传染病诊断原料(抗原和抗体)的研发和生产过程中,根据DIN EN ISO 13485的要求,抗原的生产设施需通过BSL-3认证。不仅如此,根据国务院在2018年修订《病原微生物实验室生物安全管理条例》中明确规定:从事某种高致病性病原微生物或者疑似高致病性病原微生物实验活动,须在P3或以上等级实验室进行。国内获批的P3实验室65%在疾病预防控制中心,Virion\Serion是目前在IVD行业中具有独立的P3实验室的厂商,从而可以开发和生产几乎所有与人类或动物相关的病原体原料,且可用于商业化,目前涵盖病毒、细菌、真菌、寄生虫等系列化病原体的天然抗原,既符合要求,也更加安全可靠!
Virion\Serion充分利用P3实验室的优势和40多年的研发经验,根据病原体的各自特点已优化多种表达系统,以确保生产出高品质抗原。在DIN ENISO 13485和欧盟指令98/79/EC的质量体系下,目前已成功开发和生产超过70余种传染病诊断原料,包括天然抗原、重组抗原、病毒样颗粒等系列;产品种类丰富,包括病毒、细菌、真菌、寄生虫等系列化病原体;适用于目前业内多种检测平台。

基于试剂产品开发特点,为了满足试剂用户的需求,Virion\Serion充分发挥拥有P3实验室的技术优势。Virion\Serion SARS-CoV-2抗原在实验室开发阶段就使用大量临床样本进行反复验证、持续优化。
Virion\Serion SARS-CoV-2核蛋白在ELISA和CLIA平台的临床验证结果如图6、图7。
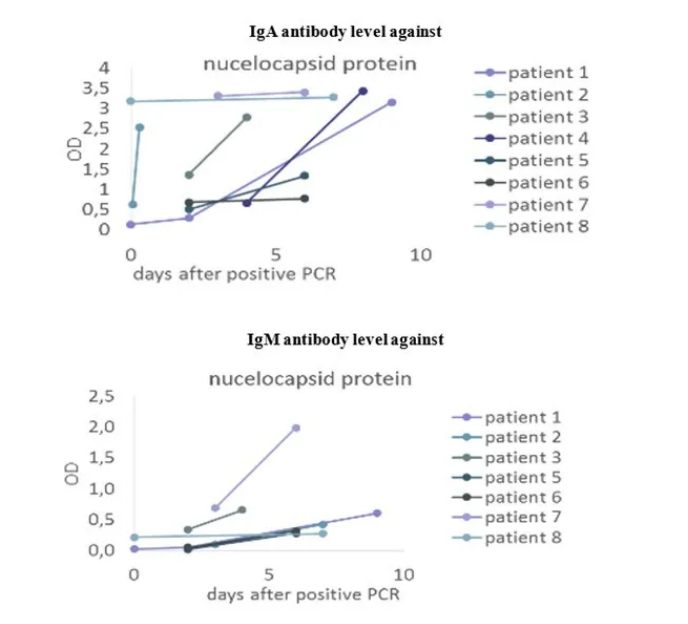
在发病早期,采集PCR阳性病例的双份血液样本(不同时间),用Virion\Serion SARS-CoV-2核蛋白在ELISA平台上分别检测IgA和IgM抗体。结果表明,Virion\Serion SARS-CoV-2 核蛋白能准确检出抗体水平变化。
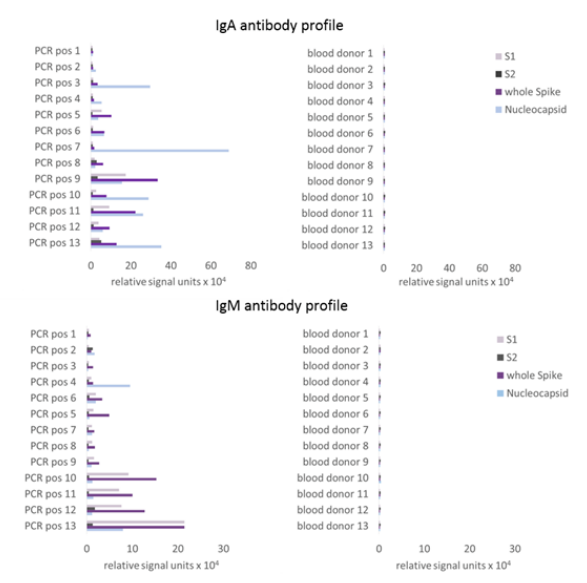
采集PCR阳性病例的血液样本,用SERION SARS-CoV-2 核蛋白在CLIA平台上分别检测IgA和IgM抗体,同时检测阴性样本。结果表明,SERION SARS-CoV-2 核蛋白能准确检测阳性样本和阴性样本。

在2018-2019收集的样本中,其中Mikrogen、Roche和Viramed的结果均出现阳性,经WB验证,样本中存在HCoVs 229E、HKU-1、NL63、OC43抗体,存在严重交叉反应;而Virion-Serion与新冠其他种属及其他呼吸道病原体无交叉反应,充分体现了Virion-Serion抗原的高特异性。

总结
目前而言,预防新冠的疫苗还未上市,新冠疫情形势严峻;核酸检测造成假阴性的情况依然未得到改善,联合血清学检测是提高对新冠检测的准确率的最佳方案;不仅众多治疗指南和专家共识提出该方案,目前各国的出行已提出血清学检测的要求,对新冠疫情防控的重视绝非一般;而准确地检测出阳性患者对试剂的性能也进一步提出了更高的要求,原料则是首当其冲,在整个试剂的研发中,原料的重要性占比70%;Virion\Serion试剂经欧洲最大的医疗中心验证,在对比中性能最佳,也为接下来的新冠检测提供了更多的选择和可能。
选择正确的原料,让您赢在起跑线上。追求卓越,选择Virion\Serion,超越您的期望!
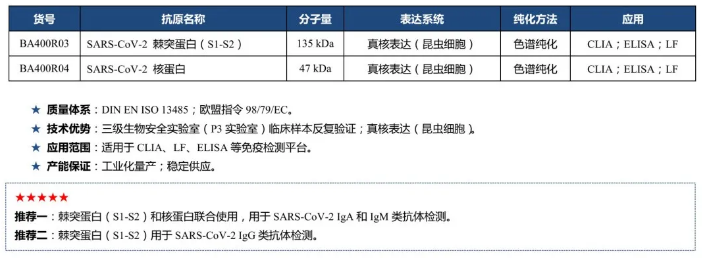
Virion\Serion SARS-CoV-2 抗原介绍及使用建议:
精雕细琢,工匠精神 ——维润赛润隆重推出“经临床验证”的SARS-CoV-2抗原

★质量体系:
DIN ENISO 13485;欧盟指令98/79/EC。
★技术优势:
BSL-3实验室。
★应用范围:
适用于LF、CLIA、ELISA等免疫检测平台。
★产能保证:
工业化量产,稳定供应。
